A.
Keadaan Stabil Atom Unsur
Pada tahun 1916, G.N. Lewis dan W. Kossel menjelaskan
alasan atom unsur-unsur golongan VIIIA (gas mulia) sulit bereaksi dengan unsur
lain atau bersifat sangat stabil. Hubungan antara konfigurasi elektron gas
mulia dengan kestabilannya selanjutnya menjadi keadaan yang ingin dicapai oleh
unsur-unsur lain. Unsur-unsur tersebut akan berikatan secara kimia dengan atom
unsur lainnya sehingga tercapai keadaan stabil seperti gas mulia. Konfigurasi
elektron unsur-unsur gas mulia ditunjukkan oleh tabel berikut.
No.
|
Unsur Gas Mulia
|
Jumlah Elektron pada Kulit Atom
(Konfigurasi Elektron)
|
|||||
K
|
L
|
M
|
N
|
O
|
P
|
||
2He
|
2
|
||||||
10Ne
|
2
|
8
|
|||||
18Ar
|
2
|
8
|
8
|
||||
36Kr
|
2
|
8
|
18
|
8
|
|||
54Xe
|
2
|
8
|
18
|
18
|
8
|
||
86Rn
|
2
|
8
|
18
|
32
|
18
|
8
|
|
Unsur gas mulia He memiliki 2 elektron valensi.
Unsur-unsur yang memiliki nomor atom kecil, seperti H dan Li akan berusaha
mencapai kestabilan dengan memiliki 2 elektron valensi seperti unsur He.
Kecenderungan untuk memiliki 2 elektron valensi ini dinamakan kaidah Duplet.
Unsur-unsur gas mulia selain He memiliki 8 elektron
valensi. Unsur-unsur lain cenderung berusaha memperoleh konfigurasi elektron
seperti gas mulia untuk mencapai kestabilan. Kecenderungan ini dinamakan kaidah
Oktet.
Untuk memenuhi kaidah Duplet atau kaidah Oktet,
atom-atom unsur akan menerima/melepas elektron atau menggunakan elektron
bersama. Peristiwa ini mengakibatkan terbentuknya ikatan kimia. Unsur-unsur
dari golongan alkali dan alkali tanah cenderung melepaskan elektron terluarnya untuk
mencapai kestabilan sehingga membentuk ion positif. Unsur-unsur yang cenderung membentuk
ion positif termasuk unsur elektropositif. Unsur-unsur dari golongan kalkogen
dan halogen cenderung menangkap elektron untuk mencapai kestabilan sehingga
membentuk ion negatif. Unsur-unsur yang cenderung membentuk ion negatif
termasuk unsur elektronegatif.
B.
Ikatan Ion
Ikatan ion merupakan ikatan kimia yang terbentuk
akibat kecenderungan atom-atom untuk menerima atau melepas elektron agar
memiliki konfigurasi elektron seperti gas mulia terdekat. Senyawa yang memiliki
ikatan ion dinamakan senyawa ion. Senyawa ion umumnya tersusun dari atom-atom
unsur logam dan unsur nonlogam. Unsur logam cenderung untuk melepas elektron
membentuk ion positif, sedangkan unsur nonlogam cenderung menerima elektron
membentuk ion negatif.
Serah terima elektron dalam ikatan ion dapat
digambarkan menggunakan lambang Lewis. Lambang Lewis suatu unsur dituliskan
dengan lambang unsur yang dikelilingi oleh oleh sejumlah tanda yang menyatakan
jumlah elektron valensi unsur tersebut. Tanda tersebut dapat berupa tanda
titik, tanda silang, atau tanda lainnya. Misal pembentukan ikatan ion pada
senyawa NaCl.
11Na
(2.8.1) → Na+ (2.8) + e-
17Cl
(2.8.7) + e- → Cl- (2.8.8)
Na+ + Cl-→ NaCl
Ikatan ion mudah terjadi jika atom-atom unsur yang
berikatan mempunyai perbedaan elektronegativitas lebih besar dari 1,7. Semakin
besar perbedaan elektronegativitas, ikatan kimia yang terbentuk semakin
bersifat ionik. Ikatan ion umumnya terbentuk antara unsur-unsur golongan IA dan
IIA (unsur logam) dengan unsur-unsur golongan VIA dan VIIA (unsur nonlogam). Kaidah
Oktet tidak dapat diterapkan untuk unsur-unsur berikut.
1.
Unsur-unsur
logam transisi
Misal unsur Cu dapat membentuk ion Cu+ dan
Cu2+. Konfigurasi elektron ion-ion tersebut tidak sama dengan
konfigurasi elektron unsur gas mulia terdekat dengan unsur Cu.
2.
Unsur-unsur
logam setelah golongan transisi
Misal unsur Sn (golongan IVA) dapat membentuk ion Sn2+
dan Sn4+. Konfigurasi elektron ion-ion tersebut tidak sama dengan
konfigurasi elektron unsur gas mulia terdekat dengan unsur Sn.
C.
Ikatan Kovalen
Ikatan kovalen merupakan ikatan yang terjadi antara unsur
nonlogam dengan unsur nonlogam lain dengan cara pemakaian bersama pasangan
elektron. Ada perkecualian yaitu unsur logam Be yang cenderung berikatan secara
kovalen dengan atom unsur nonlogam. Jumlah elektron valensi yang digunakan
untuk berikatan tergantung pada kebutuhan tiap atom untuk mencapai konfigurasi
elektron seperti gas mulia.
Atom-atom yang bergabung melaui ikatan kovalen
dinamakan molekul. Jika atom-atom tersebut berasal dari unsur sejenis maka
dinamakan molekul unsur. Contoh H2, O2, Cl2, P4,
dan S8. Jika atom-atom tersebut berasal dari unsur-unsur berbeda
jenis maka dinamakan molekul senyawa. Contoh HCl, CO2, CH4,
dan H2SO4.
Penggunaan bersama pasangan elektron dalam ikatan
kovalen dapat dituliskan menggunakan struktur Lewis. Penulisan struktur Lewis
menggunakan simbol-simbol, seperti titik, tanda silang, atau tanda lainnya. Contoh
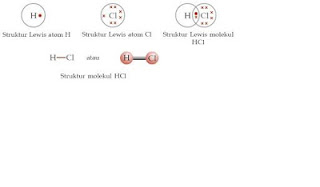
penulisan struktur Lewis terbentuknya ikatan kovalen pada senyawa HCl.
1H:
1
17Cl:
2.8.7
Berdasarkan bentuk ikatannya, ikatan kovalen dibagi
menjadi tiga, yaitu ikatan kovalen normal, ikatan kovalen koordinasi, serta ikatan
kovalen polar dan nonpolar.
1. Ikatan
kovalen normal
Pasangan
elektron yang digunakan pada pembentukan ikatan kovalen berasal dari kedua
atom. Jumlah ikatan yang terdapat dalam suatu molekul dapat diramalkan dengan
menghitung jumlah elektron yang digunakan bersama-sama. Berdasarkan jumlah
ikatannya, ikatan kovalen dibagi menjadi tiga sebagai berikut.
a.
Ikatan
kovalen tunggal
Ikatan
kovalen tunggal adalah ikatan kovalen yang terbentuk karena pemakaian bersama
satu pasang elektron. Ikatan ini dilambangkan dengan satu garis lurus. Contoh
ikatan pada senyawa CH4.
6C: 2.4
1H: 1
b.
Ikatan
kovalen rangkap dua
Ikatan
kovalen rangkap dua adalah ikatan kovalen yang terbentuk karena pemakaian
bersama dua pasang elektron. Ikatan ini dilambangkan dengan dua garis lurus.
Contoh ikatan pada senyawa CO2.
6C: 2.4
8O: 2.6
c.
Ikatan
kovalen rangkap tiga
Ikatan
kovalen rangkap tiga adalah ikatan kovalen yang terjadi karena pemakaian
bersama tiga pasang elektron. Ikatan ini dilambangkan dengan tiga garis lurus.
Contoh ikatan pada senyawa N2.
7N: 2.5
2. Ikatan
Kovalen Koordinasi
Ikatan
kovalen koordinasi adalah ikatan kovalen dengan pasangan elektron yang
digunakan bersama berasal dari salah satu atom yang berikatan. Ikatan ini dapat
terjadi antara suatu atom yang mempunyai pasangan elektron bebas dan sudah
mencapai konfigurasi oktet dengan atom lain yang membutuhkan dua elektron untuk
mencapai konfigurasi oktet. Contoh pada senyawa SO3.
Tanda panah (→) menunjukkan sumber pasangan elektron
yang digunakan bersama.
3. Ikatan
Kovalen Polar dan nonpolar
Ikatan
kovalen polar adalah ikatan kovalen yang atom-atomnya memiliki parsial positif
dan negatif. Pasangan elektron dalam ikatan kovalen polar digunakan secara
tidak seimbang sehingga terjadi kepolaran muatan. Ikatan kovalen nonpolar
adalah ikatan kovalen yang pasangan elektron dalam ikatan kovalen digunakan
secara seimbang sehingga tidak terjadi pengkutuban atau kepolaran muatan.
Kepolaran suatu molekul secara umum dijelaskan sebagai berikut.
a. Suatu molekul
dwiatom bersifat nonpolar apabila memiliki ikatan kovalen nonpolar. Contoh
molekul H2, Cl2,dan O2.
b. Suatu molekul
dwiatom bersifat polar apabila memiliki ikatan kovalen polar. Contoh molekul
HCl dan HF.
c. Suatu molekul
poliatom bersifat nonpolar apabila bentuk molekulnya simetris. Contoh CCl4,
CO2, dan BCl3.
d. Suatu molekul
poliatom bersifat polar apabila bentuk molekulnya tidak simetris. Contoh H2O,
NH3, dan CHCl3.
D.
Ikatan Logam
Menurut teori lautan elektron, atom logam harus
berikatan dengan banyak atom logam lainnya untuk mencapai konfigurasi elektron
gas mulia. Misal atom Na yang memiliki 1 elektron valensi harus berikatan
dengan minimum 7 atom Na lainnya untuk dapat memiliki 8 elektron. Tempat
kedudukan elektron valensi dari suatu atom Na dapat saling tumpang tindih
dengan tempat kedudukan elektron valensi dari atom-atom Na lainnya. Tumpang
tindih tersebut memungkinkan elektron valensi dari setiap atom Na bergerak
bebas dalam ruang di antara ion-ion Na+ membentuk lautan elektron.
Oleh karena muatannya berlawanan, akan terjadi gaya tarik-menarik antara
ion-ion Na+ dan elektron-elektron bebas tersebut. Akibatnya,
terbentuk ikatan akibat penggunaan bersama elektron-elektron valensi antaratom
logam. Ikatan tersebut dinamakan ikatan logam. Semakin besar jumlah muatan
positif ion logam maka semakin banyak jumlah elektron bebasnya sehingga semakin
besar kekuatan ikatan logam. Hal ini yang dapat menjelaskan bahwa logam Na
lebih lunak daripada logam Al. Logam natrium dan aluminium terbentuk dari
atom-atom yang bergabung melalui ikatan
logam.
E.
Sifat Fisis Senyawa Ion, Senyawa Kovalen, Logam
Sifat fisis suatu zat ditentukan oleh gaya
antarpartikel penyusun zat. Sifat fisis senyawa ion, senyawa kovalen, dan logam
sebagai berikut.
1. Sifat fisis
senyawa ion
Sifat
fisis senyawa ion ditentukan oleh gaya elektrostatis yang kuat dan sama ke
segala arah. Sifat-sifat fisis senyawa ion sebagai berikut.
a. Berwujud
padatan pada suhu kamar
Adanya
gaya elektrostatis yang kuat antar ion-ion positif dan negatif mengakibatkan
posisi ion-ion dalam kisi kristal senyawa ion bersifat tetap. Ion-ion tersebut
tidak dapat bergerak bebas.
b. Bersifat
keras tetapi rapuh
Kristal
senyawa ion bersifat keras karena lapisan-lapisannya mengandung ion-ion positif
dan negatif yang terikat oleh gaya elektrostatis yang kuat ke segala arah. Akan
tetapi, jika diberi gaya dari luar, lapisan-lapisan dalam kristal dapat
bergeser, ion sejenis saling tumpang tindih lalu tolak-menolak, terjadi
pemisahan, dan kristal hancur.
c. Mempunyai
titik leleh dan titik didih tinggi
Saat
terkena suhu tinggi, ion-ion dalam senyawa ion dapat memperoleh energi kinetik
yang cukup untuk mengatasi gaya elektrostatis sehingga dapat bergerak.
d. Larut dalam
pelarut air dan tidak larut dalam pelarut organik
Senyawa
ion dapat larut dalam air karena sama-sama bersifat polar. Kepolaran air mampu
mengatasi gaya elektrostatis dalam senyawa ion sehingga terjadi pemisahan
ion-ion atau pelarutan. Senyawa ion umumnya tidak larut dalam pelarut organik,
seperti alkohol yang bersifat nonpolar.
e. Tidak
menghantarkan listrik dalam fase padat, tetapi menghantarkan listrik dalam fase
cair atau larutan
Suatu
zat dapat menghantarkan listrik jika berbentuk ion-ion yang dapat bergerak
bebas dengan membawa muatan listrik. Dalam bentuk padat, ion positif dan
negatif senyawa ion tidak dapat bergerak bebas. Sementara itu, dalam bentuk
cair dan larutan, ion-ion tersebut dapat bergerak bebas sehingga dapat
menghantarkan listrik.
2. Sifat fisis
senyawa kovalen
Gaya antarmolekul (gaya Van der Waals) menentukan
sifat fisis senyawa kovalen. Beberapa sifat fisis senyawa kovalen sebagai
berikut.
a.
Pada
suhu kamar berwujud gas, cairan, atau padatan lunak
Molekul-moleku dalam senyawa kovalen terikat oleh gaya
antarmolekul yang lemah sehingga dapat bergerak relatif lebih bebas.
b.
Bersifat
lunak dan tidak rapuh
Gaya antarmolekul yang lemah pada senyawa kovalen
dalam fase padat mengakibatkan molekul-molekul dalam struktur kristal mudah
bergeser. Akibatnya, senyawa kovalen bersifat lunak dan tidak rapuh.
c.
Mempunyai
titik didih dan titik leleh yang rendah
Pada suhu rendah, molekul-molekul dapat memperoleh
energi kinetik yang cukup untuk mengatasi gaya antarmolekul kovalen yang
relatif lemah.
d.
Umumnya
tidak larut dalam air tetapi larut dalam pelarut organik
Senyawa kovalen umumnya tidak larut dalam air tetapi
larut dalam pelarut organik, kecuali senyawa kovalen yang bersifat polar.
e.
Umumnya
tidak dapat menghantarkan listrik
Senyawa kovalen tidak memiliki ion atau elektron yang
bergerak bebas untuk membuat muatan listrik. Akan tetapi, beberapa senyawa
kovalen polar yang larut dalam air akan terhidrolisis membentuk ion-ion sehingga
dapat menghantarkan listrik.
3. Sifat fisis
logam
Sifat
fisis logam ditentukan oleh kekuatan ikatan logam, kerapatan struktur, dan
keberadaan elektron bebas. Beberapa sifat fisis logam sebagai berikut.
a. Pada suhu
kamar berwujud padat
Atom-atom
logam mempunyai ikatan kuat dan bentuk struktur kristal yang rapat sehingga
tidak bebas bergerak seperti zat cair, kecuali Hg.
b. Bersifat
keras tetapi lentur atau tidak mudah patah jika ditempa
Adanya
ikatan yang kuat dan struktur yang rapat mengakibatkan logam bersifat kuat, keras,
dan rapat. Akan tetapi adanya elektron-elektron bebas mengakibatkan logam
bersifat lentur atau tidak mudah patah.
c. Menghantarkan
listrik dan panas dengan baik (konduktor)
Jika
diberi tegangan, elektron-elektron bebas yang membawa muatan listrik akan
bergerak dari kutub negatif menuju kutub positif. Jika dipanaskan,
elektron-elektron akan memperoleh energi kinetik yang cukup untuk bergerak
cepat. Elektron-elektron akan bertumbukan dengan elektron-elektron lainnya.
Akibatnya, terjadi transfer energi bagian yang bersuhu tinggi ke bagian bersuhu
rendah.
d. Mempunyai
permukaan mengilap
Pada saat
cahaya jatuh pada permukaan logam, elektron-elektron bebas akan menyerap energi
cahaya tersebut. Elektron-elektron akan melepas kembali energi tersebut dalam
bentuk radiasi elektromagnetik dengan frekuensi sama dengan cahaya semula.
Akibatnya, pantulan cahaya yang datang akan membuta permukaan logam terlihat
mengilap.






No comments:
Post a Comment