A. Atom
Zat-zat yang ada di sekitar kita tersusun dari bagian
terkecil yang dinamakan atom. Menurut Demokritus, seorang filsafat Yunani
(460-370 SM) mengartikan bahwa atom merupakan partikel terkecil yang tidak
dapat dibagi lagi. Pendapat tersebut disangkal oleh Aristoteles (384–322
SM) yang menyatakan bahwa materi
bersifat kontinu (materi dapat dibelah terus-menerus sampai tidak berhingga).
Aristoteles lebih menyetujui teori Empedokles, yaitu materi tersusun atas api,
air,
tanah,
dan udara. Anggapan
tersebut selanjutnya digunakan oleh para ilmuwan hingga berabad-abad sampai
munculnya John Dalton (1805) yang mengemukakan teori atomnya.
1.
Partikel Penyusun Atom
Atom pada dasarnya tersusun dari inti atom dan
elektron yang mengelilinginya. Inti atom tersusun dari proton dan neutron.
a.
Elektron
Penemuan elektron diawali dari percobaan tabung sinar
katode yang dilakukan pertama kali oleh William Crookes (1875). Crookes
menemukan sinar yang muncul dari arah katode menuju anode. Oleh George
Johnstone Stoney (1891), sinar katode ini dinamakan elektron. Pada tahun 1897,
Joseph John Thomson melanjutkan eksperimen William Crookes. Thomson mengamati
pengaruh medan listrik dan medan magnet dalam tabung sinar katode. Hasilnya,
Thomson dapat membuktikan bahwa ada partikel bermuatan negatif dalam suatu atom
karena sinar katode dapat dibelokkan ke arah kutub positif medan listrik.
Sumber: http://mfyeni.wordpress.com/kelas-x/perkembangan-teori-atom/struktur-atom/
Gambar 1.1
Percobaan Pengaruh medan listrik dan medan magnet dalam tabung sinar katode
Robert Andrew Milikan (1908) berhasil menemukan
besarnya muatan elektron melalui percobaan tetes minyak Milikan, yaitu sebesar
1,6022 x 10-19 coulomb. Dengan demikian massa elektron dapat
dihitung yaitu sebesar 9,1096 x 10-28 g. Berdasarkan
percobaan-percobaan tersebut dan untuk lebih memudahkan, muatan elektron diberi
nilai = -1 dan massa elektron = 0, sehingga elektron dapat dilambangkan
.
Sumber:
http://mfyeni.wordpress.com/kelas-x/perkembangan-teori-atom/struktur-atom/
Gambar 1.2
Percobaan tetes minyak Milikan
b.
Proton
Eugene Goldstein (1886) melakukan percobaan
menggunakan tabung gas yang memiliki katode. Tabung gas tersebut diberi
lubang-lubang dan muatan listrik. Pada saat terbentuk elektron yang menuju
anode ternyata terbentuk pula sinar positif yang menuju arah berlawanan
melewati lubang pada katode. Di antara beberapa gas, gas hidrogen yang
menunjukkan hasil sinar muatan positif paling kecil dengan massa paling kecil.
Selanjutnya, sinar ini disebut sebagai proton. Berdasarkan percobaan
disimpulkan bahwa massa proton = 1 sma (satuan massa atom) dan muatan proton =
+1. Proton dilambangkan dengan
.
Gambar 1.3
Percobaan Golsdstein untuk menemukan proton
c.
Neutron
Ernest Rutherford melakukan penelitian penembakan
lempeng emas tipis. Hasilnya, Rutherford menyatakan bahwa atom tersusun dari
inti atom yang bermuatan positif dan dikelilingi elektron yang bermuatan
negatif sehingga atom bersifat netral. Sementara itu, massa inti atom tidak
seimbang dengan massa proton yang terdapat dalam inti atom. Dengan demikian
diperkirakan ada partikel lain di dalam inti atom.
Gambar 1.4
Percobaan penembakan lempeng tipis emas
W. Bothe dan H. Becker (1930) melakukan percobaan
penembakan partikel alfa pada inti atom berilium. Percobaan ini menghasilkan
radiasi partikel berdaya tembus tinggi. Pada tahun 1932, James Chadwick
melanjutkan eksperimen dan menemukan bahwa partikel yang menimbulkan radiasi
berdaya tembus tinggi tersebut bersifat netral (tidak bermuatan) dan massanya
hampir sama dengan proton. Partikel tersebut selanjutnya dinamakan neutron.
Neutron dilambangkan dengan
2. Nomor
Atom dan Nomor Massa
Keterangan:
X = lambang unsur
A = nomor massa
Z = nomor atom
Nomor atom (Z) = jumlah proton
Nomor massa (A) = jumlah proton + jumlah
neutron
Jumlah neutron = nomor massa – jumlah
proton/nomor atom
Jumlah elektron = proton untuk atom
netral, jumlah
elektron kurang dari
jumlah
proton untuk ion positif,
dan jumlah
elektron lebih dari
jumlah
proton untuk ion negatif.
Nomor atom (Z)
menunjukkan jumlah proton (muatan positif) atau jumlah elektron dalam atom
tersebut. Jika
atom bersifat netral maka jumlah proton sama dengan jumlah elektronnya,
sehingga nomor atom juga menunjukkan jumlah elektron. Nomor atom merupakan ciri khas
suatu unsur. Jumlah elektron
inilah yang paling menentukan sifat suatu unsur. Nomor atom ditulis agak ke
bawah sebelum lambang unsur. Massa
elektron sangat kecil dan dianggap nol sehingga massa atom ditentukan oleh inti
atom yaitu proton dan neutron. Nomor massa (A) menyatakan banyaknya proton dan
neutron yang menyusun inti atom suatu unsur. Nomor massa ditulis agak ke atas
sebelum lambang unsur.
3.
Isotop, Isobar, dan Isoton
Isotop, isobar, dan isoton merupakan suatu persamaan
yang dimiliki oleh beberapa unsur.
a.
Isotop adalah unsur-unsur yang mempunyai nomor atom atau proton yang
sama tetapi nomor massanya berbeda.
b.
Isobar adalah
unsur-unsur yang mempunyai nomor massa yang
sama tetapi nomor atom atau protonnya berbeda.
c.
Isoton adalah
unsur-unsur yang mempunyai jumlah neutron sama tetapi jumlah protonnya berbeda.
Hampir semua unsur di alam yang telah
ditentukan jumlah proton dan neutronnya memiliki lebih dari satu isotop. Oleh
karenanya, massa atom suatu unsur dapat ditentukan dengan menghitung kelimpahan
setiap isotop unsur yang bersangkutan tersebut di alam.
Contoh soal:
Suatu unsur di alam memiliki isotop
dan
dengan kelimpahan secara berturut-turut 69,1 %
dan 30,9 %. Berapa massa rata-rata atom unsur X?
Jawaban:
Massa rata-rata atom X dapat dihitung dengan cara
menghitung kelimpahan dari kedua isotop.
Ar =
=
= 63,62
4.
Konfigurasi
Elektron dan Elektron Valensi
Elektron
yang mengelilingi inti atom berada pada lintasan tertentu yang dinamakan kulit
atom. Lambang kulit atom dimulai dari yang dekat dengan inti meliputi kulit K,
L, M, N, dan seterusnya. Semakin jauh dari inti atom, tingkat energi dari kulit
atom semakin tinggi. Jumlah elektron yang menempati suatu lintasan atau kulit
berbeda-beda. Susunan elektron dalam setiap lintasan atau kulit atom dinamakan
konfigurasi elektron. Dengan mengetahui konfigurasi elektron suatu atom, dapat
ditentukan nomor golongan, nomor periode, dan elektron valensi suatu atom. Perhatikan
gambar berikut!
Gambar
1.5 Kulit atom dan elektron yang menempatinya
Jumlah elektron
maksimum pada kulit ke-n= 2n2. Misal kulit pertama (n = 1) berisi maksimum 2
elektron, kulit kedua (n = 2) berisi maksimum 8 elektron, kulit ketiga (n = 3)
berisi maksimum 18 elektron, dan kulit keempat (n = 4) berisi maksimum 32
elektron. Cara pengisian konfigurasi elektron ditunjukkan oleh contoh pada
tabel berikut.
Nomor Atom (Jumlah Elektron)
|
Konfigurasi Elektron
|
1
4
12
15
19
20
35
|
1
2.2
2.8.2
2.8.5
2.8.8.1
2.8.8.2
2.8.18.7
|
Konfigurasi elektron pada unsur dengan nomor atom 19 dan 20 tidak
dituliskan dengan konfigurasi elektron 2.8.9 dan 2.8.10. Hal ini berhubungan
dengan pengisian elektron yang didahulukan sub kulit yang mempunyai tingkat
energi lebih rendah terlebih dahulu. Cara penulisan konfigurasi elektron
menggunakan sub kulit akan dipelajari pada materi di kelas XI.
Elektron valensi adalah jumlah elektron pada kulit
terluar suatu atom netral. Elektron valensi berperan dalam reaksi pembentukan
ikatan kimia dan reaksi kimia. Jumlah elektron valensi ditentukan berdasarkan
elektron yang terdapat pada kulit terakhir dari konfigurasi elektron suatu atom
unsur. Unsur-unsur yang memiliki jumlah elektron valensi sama akan memiliki
sifat kimia yang sama pula. Contoh penentuan jumlah elektron valensi sebagai
berikut.
Unsur
mempunyai nomor atom 17. Konfigurasi
elektronnya yaitu 2.8.7. Jumlah elektron valensinya 7.
B. Perkembangan
Teori Atom
Teori atom
pada awalnya dikemukakan oleh Democritus. Democritus berpendapat
bahwa jika suatu benda dibelah secara
terus-menerus, pada saat tertentu akan diperoleh bagian yang tidak dapat
dibelah lagi. Bagian seperti ini oleh Democritus disebut atom. Istilah atom berasal dari bahasa Yunani, yaitu “a” yang artinya tidak dan “tomos” yang artinya dibagi. Jadi,
atom adalah bagian terkecil dari suatu unsur yang tidak dapat dibelah lagi tetapi masih memiliki sifat kimia dan sifat fisika
benda asalnya. Selanjutnya, penentuan
gambaran susunan partikel-partikel dasar di dalam atom (model atom) mengalami
perkembangan. Urutan perkembangan tersebut sebagai berikut.
1.
Model
Atom Dalton
Teori atom menurut John Dalton didasarkan pada dua
hukum, yaitu hukum kekekalan massa (hukum Lavoisier) dan hukum perbandingan
tetap (hukum Proust). Pokok-pokok teori atom Dalton sebagai berikut.
a.
Atom merupakan bagian terkecil dari materi yang sudah
tidak dapat dibagi lagi.
b.
Atom digambarkan sebagai bola pejal yang sangat kecil. Suatu unsur
memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda.
c.
Atom-atom bergabung membentuk senyawa dengan
perbandingan bilangan bulat dan sederhana. Misal air terdiri atas atom-atom hidrogen dan atom-atom oksigen dengan perbandingan tertentu.
d.
Reaksi kimia merupakan pemisahan, penggabungan, atau
penyusunan kembali atom-atom, sehingga atom tidak dapat diciptakan atau
dimusnahkan.
Model atom
Dalton digambarkan sebagai bola pejal pada tolak peluru.
Gambar 1.6 Model atom
Dalton
Teori atom Dalton tidak menerangkan hubungan
antara larutan senyawa dan daya hantar arus listrik. Teori atom ini selanjutnya disempurnakan oleh
Thomson.
2.
Model
Atom Thomson
Teori atom menurut J. J. Thomson menyatakan bahwa atom
merupakan bola pejal yang bermuatan positif dan di dalamnya tersebar elektron
yang bermuatan negatif. Model atom Thomson digambarkan sebagai
jambu biji yang sudah dikelupas kulitnya. Biji jambu menggambarkan elektron
yang tersebar merata
dalam bola daging jambu yang pejal dan bermuatan positif.
Gambar 1.7 Model
atom Thomson
Kelemahan teori atom Thomson yaitu tidak
dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut. Kelemahan teori ini selanjutnya disempurnakan oleh
Rutherford.
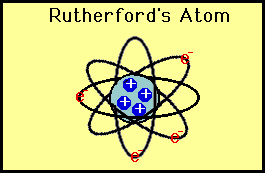
3.
Model
Atom Rutherford
Rutherford mengadakan percobaan hamburan sinar alfa
dari uranium. Kesimpulan dari percobaan tersebut sebagai berikut.
a.
Atom
adalah bola berongga yang tersusun dari inti atom dan elektron yang
mengelilinginya.
b.
Inti
atom bermuatan positif dan massa atom terpusat pada inti atom.
Teori atom ini mempunyai kelemahan yaitu tidak dapat
menjelaskan alasan elektron tidak dapat jatuh ke dalam inti atom. Menurut teori
fisika, gerakan elektron mengitari inti atom disertai pemancaran energi. Oleh
karenanya, energi elektron lama-kelamaan akan berkurang dan lintasannya semakin
lama mendekati inti lalu jatuh ke dalam inti.
Gambar 1.8 Model
atom Rutherford
4.
Model
Atom Niels Bohr
Niels Bohr memperbaiki kegagalan
atom Rutherford melalui percobaannya tentang spektrum atom hidrogen. Percobaan Bohr menghasilkan beberapa kesimpulan
sebagai berikut.
a.
Atom
terdiri atas inti yang bermuatan positif dan dikelilingi elektron bermuatan
negatif di dalam suatu lintasan.
b.
Elektron
dapat berpindah dari suatu lintasan ke lintasan yang lain dengan menyerap
energi (berpindah ke lintasan yang lebih tinggi) atau memancarkan energi
(berpindah ke lintasan yang lebih rendah) sehingga energi elektron atom tidak
akan berkurang.
Gambar
1.9 Model atom Bohr
c.
Elektron-elektron
berkedudukan pada tingkat-tingkat energi tertentu yang disebut kulit-kulit
elektron.
Kelemahan
teori ini adalah tidak dapat
menjelaskan spektrum warna dari atom berelektron banyak. Selain itu, teori atom Bohr juga tidak
dapat menerangkan kejadian-kejadian dalam ikatan kimia dengan baik serta pengaruh medan magnet terhadap
atom-atom.
5. Model Atom Modern (Model Atom Mekanika Kuantum)
Pada tahun 1926, Erwin Schrodinger mengembangkan model atom mekanika
kuantum. Sebelum Erwin Schrodinger, seorang
ahli dari Jerman Werner Heisenberg mengembangkan teori mekanika kuantum yang
dikenal dengan prinsip ketidakpastian. Prinsip ketidakpastian tersebut menyatakan bahwa tidak
mungkin dapat ditentukan kedudukan dan momentum suatu benda secara seksama pada
saat bersamaan, yang dapat ditentukan adalah kebolehjadian menemukan elektron
pada jarak tertentu dari inti atom.
Daerah
ruang di sekitar inti dengan kebolehjadian untuk mendapatkan elektron disebut
orbital. Bentuk dan tingkat energi orbital dirumuskan oleh Erwin Schrodinger. Model atom dengan orbital lintasan
elektron ini disebut model atom modern atau model atom mekanika kuantum yang
berlaku sampai sekarang.
Gambar 1.10 Model
atom mekanika kuantum
Awan
elektron yang berada di sekitar inti
menunjukkan tempat
kebolehjadian elektron. Orbital menggambarkan tingkat energi elektron.
Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk
subkulit. Beberapa subkulit bergabung membentuk kulit. Dengan
demikian, kulit
terdiri atas beberapa
subkulit dan subkulit terdiri atas beberapa
orbital. Meskipun posisi kulit
sama, tetapi
posisi orbital belum tentu sama.
Model atom mekanika kuantum mempunyai beberapa ciri khas sebagai berikut.
a.
Gerakan elektron memiliki sifat gelombang sehingga
lintasannya (orbitnya) tidak stasioner seperti model Bohr, tetapi mengikuti
penyelesaian kuadrat fungsi gelombang yang disebut orbital (bentuk tiga dimensi
dari kebolehjadian
paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom).
b.
Bentuk dan
ukuran orbital bergantung pada harga dari ketiga bilangan kuantumnya. Elektron
yang menempati orbital dinyatakan dalam bilangan kuantum tersebut.
c.
Posisi elektron sejauh 0,529 Amstrong dari inti H
menurut Bohr bukannya sesuatu yang pasti, tetapi bolehjadi merupakan peluang
terbesar ditemukannya elektron.
Kelemahan model atom mekanika kuantum ini adalah
persamaan
gelombang Schrodinger hanya dapat diterapkan secara eksak untuk partikel dalam
kotak dan atom dengan elektron tunggal.









No comments:
Post a Comment